fisica
quantistica molecolare bio-chimica
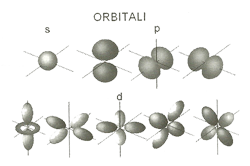
| MECCANICA QUANTISTICA E POTENZIALE QUANTICO - tratto da L'ATOMO E LE PARTICELLE ELEMENTARI di Massimo Teodorani - 12-10-2011 Un orbitale non è una traiettoria in senso classico, ma soIo una zona abbastanza indefinita dove è probabile che l'elettrone si trovi. Tutto ciò è una diretta conseguenza di un altro fondamentale principio della meccanica quantistica, questa volta scoperto dal fisico teorico tedesco "Werner Heisenberg (1901-1976). Questo principio - denominato Principio di Indeterminazione -dice che non è possibile conoscere simultaneamente la posizione e la velocità dell'elettrone nella sua orbita, allo stesso modo in cui studieremmo la traiettoria di un sasso nell'aria o di un satellite nello spazio. Ciò significa che non c'è modo di conoscere la traiettoria dell'elettrone, ma solo la probabilità che esso si trovi in un punto anziché in un altro. In tal modo noi possiamo solamente definire un volume di spazio dove un elettrone potrebbe essere trovato la maggior parte del tempo. È proprio questo volume dì spazio a essere chiamato "orbitale", e rappresenta il livello energetico (o stato quantico) dell'atomo. Ogni orbitale è un po' un compromesso tra l'attrazione dell'elettrone con il nucleo e la repulsione dei vari elettroni tra loro. Per cui si può ben immaginare quanto la situazione diventi complicata quando invece di considerare un atomo con un solo protone e un solo elettrone come l'idrogeno, si considerano atomi più complessi, come ad esempio quelli dell'Azoto o del Magnesio, dove il numero di elettroni e protoni è di gran lunga maggiore. SÌ può ben intuire che in queste situazioni le interazioni inter-parricellari diventano di volta in volta più complesse.
Per quello che riguarda i singoli orbitali e la loro occupazione da parte degli elettroni, esistono delle condizioni di quantizzazione non solo per quello che riguarda il livello energetico in sé, ma anche per ciò che concerne l'orientazione e la forma dell'orbitale e il senso di rotazione (ovvero il cosiddetto "momento angolare") degli elettroni stessi che viene comunemente defìnito "spin". Gli elettroni possono infatti assumere due valori mutuamente esclusivi per quello che riguarda lo spin, che possono essere numeri semi-interi dati da +1/2 e da —1/2. Ma hanno (come anche - come si vedrà in seguito — altre particelle della stessa famiglia denominate "fermioni") anche una prerogativa esclusiva: due elettroni possono occupare lo stesso livello energetico (o stato quantico) solo ed esclusivamente se essi hanno gli spin invertiti. Questo fondamentale principio, che governa il comportamento della materia come la conosciamo, si chiama Principio di Esclusione di Pauli, dal nome del fisico Wolfgang Pauli (1900-1958) che lavorava indipendentemente e parallelamente ai suoi colleghi del tempo all'elaborazione matematica della teoria quantlstica. Ciò significa che due elettroni con spin entrambi di +1/2 non possono occupare lo stesso stato quantico, mentre possono farlo solo se hanno spìn di segno opposto. Quando il livello energetico (o orbitale) è pieno, allora gli elettroni saranno obbligati a occupare un orbitale a maggiore energia seguendo sempre la stessa regola per l'accoppiamento degli spin, fino a che tutti gli orbitali non sono riempiti di elettroni. E ovvio che quanto maggiore è il numero di elettroni, tanto più complicata sarà la combinazione ottenibile per gli orbitali.
Il principio di Pauli è anche responsabile della grande stabilità della materia nella sua globalità per come la conosciamo e la tocchiamo. Le molecole — che sono agglomerati di atomi tra loro legati — non possono essere infilate arbitrariamente l'u-na dentro l'altra e questo nonostante il fatto che gli atomi che compongono le molecole siano costituiti soprattutto dal vuoto che separa i nuclei dagli elettroni. Tutto ciò accade perché agli elettroni legati che si trovano in ciascuna molecola è proibito di entrare nello stesso stato quantistico (ovvero: l'orbitale) degli elettroni che si trovano nelle altre molecole. Se il principio di Pauli non valesse, ìa materia sarebbe senza forme per come le conosciamo, e l'universo dei pianeti, delle stelle e degli oggetti che hanno le forme più dispatate, non esisterebbe. Proprio per questo è davvero il principio di Pauli la ragione per la quale i nostri corpi non cadono attraverso il pavimento!
Il modello dì Bohr rappresentò dunque la tappa fondamentale che permise di fissare una volta per tutte le regole che governano l'atomo. Ciò fu reso possibile dalle profonde intuizioni di Bohr e dalla sua capacità di studiare con estrema attenzione l'altra parallela rivoluzione che si stava rapidamente diffondendo: la teoria quantistica. In tal modo le leggi dell'atomo venivano armonìosamente agganciate alle scoperte teoriche e alle tecniche matematiche della meccanica quantistica, sviluppatesi in maniera vertiginosa grazie al contributo di fisici teorici e sperimentali come Max Planck, Albert Einstein, Werner Heisenberg, Wolfgang Pauli, Erwìn Schròdinger (1887-1961), John Von Neumann (1903-1957), Louis De Broglie (1892-1987) e David Bohm (1917-1992). Tutti erano ormai concordi nell'affermare che le particelle elementari come l'elettrone hanno un doppio comportamento: sia quello di particella che quello di onda. Tutto ciò fu dimostrato sperimentalmente. In particolare, di grande interesse fu l'esperimento "della doppia fenditura" (all'inizio nato solo come "esperimento mentale", come si dice nel gergo dei fisici teorici) in cui si osservò che facendo passare due elettroni attraverso una doppia fenditura essi interferivano tra loro allo stesso modo in cui due onde prodotte da due sassi lanciati in uno stagno tendono a sovrapporsi.
L'elettrone mostrava di comportarsi ora come particella, ad esempio quando saltava da un orbitale all'altro, e ora come onda, come nel caso dell'esperimento della fenditura. Questo comportamento ambìguo era alla base della legge quantlstica di indeterminazione che governa il comportamento indefinito dell'elettrone nell'atomo, dal momento che non è mai possibile stabilire simultaneamente dove esso sì trovi e a quale velocità esso vada. L'unico modo per saperlo con un certo margine di approssimazione è quello di trattarlo talora come un'onda, e infatti la legge che permette di stabilire la probabilità di trovare l'elettrone è interamente governata da una funzione matematica scoperta da Schrodinger - denominata "funzione d'onda", in grado non di localizzare con precisione le coordinate precise dell'elettrone ma di definire un volume di spazio entro cui l'elettrone si può trovare con maggiore probabilità. Ciò portò infatti a definire bene che cosa era esattamente un "orbitale", ma anche a rileggere interamente il comportamento chimico degli atomi nella loro globalità alla luce delle scoperte della meccanica quantlstica. In seguito ci si rese conto che le leggi quantìstìche potevano essere applicate non solo all'elettrone degli orbitali stessi, ma anche alle particelle che esistono nei nuclei. |
 |
 |
 |
 |